新股消息 | 荃信生物二次递表港交所 主攻自免及过敏性疾病领域
2023-10-05 08:02:16 70
据港交所10月3日披露,江苏荃信生物医药股份有限公司–B(荃信生物)向港交所主板提交上市申请,中金公司为其独家保荐人。据悉,该公司曾于2023年3月31日向港交所主板递交过上市申请。

招股书显示,荃信生物是一家完全专注于针对自身免疫及过敏性疾病生物疗法的临床阶段生物科技公司。该司有两个核心产品QX002N及QX005N,均是自行开发。QX002N是一种处于III期临床试验的IL-17A抑制剂,治疗强直性嵴柱炎(AS)疗效良好。QX005N则是一种阻断IL-4R的单克隆抗体(mAb),而IL-4R是一种针对广泛适应症进行研究的经验证靶点。
荃信生物已在中国启动QX005N用于特应性皮炎(AD)、结节性痒疹(PN)及慢性鼻窦炎合并鼻息肉(CRSwNP)的II期临床试验。截至最后实际可行日期(指2023年9月23日),公司就核心产品有19项专利及专利申请。截至同日,除核心产品外,荃信生物还有其他七种管线候选药物,其中四种处于临床阶段。公司的产品管线涵盖了在中国自身免疫和过敏性疾病有明显医疗需求的四个主要领域,即皮肤、风湿、呼吸道及消化道疾病。
市场格局方面,根据弗若斯特沙利文的资料,于2022年,中国的AS患者人数为390万人,估计于2030年将达到400万人。于2022年,中国AS药物市场规模为18亿美元,预计到2030年将达到65亿美元,复合年增长率为17.4%。QX002N获得批准及商业化后,荃信生物预期,QX002N将面临跨国制药公司获批生物药物的激烈竞争以及在中国用于AS的临床开发候选药物的潜在竞争。
荃信生物提到,截至最后实际可行日期,该等药物及候选药物全为TNF抑制剂及IL-17抑制剂。TNF抑制剂包括阿达木单抗及多种阿达木单抗生物类似药及拟定生物类似药。截至最后实际可行日期,中国有两种IL-17A抗体药物(即司库奇尤单抗及依奇珠单抗)获批准用于治疗AS,两者亦已获FDA批准。截至同日,除荃信生物的QX002N外,中国还有九种处于临床阶段适用于AS靶向IL-17的候选生物药物。
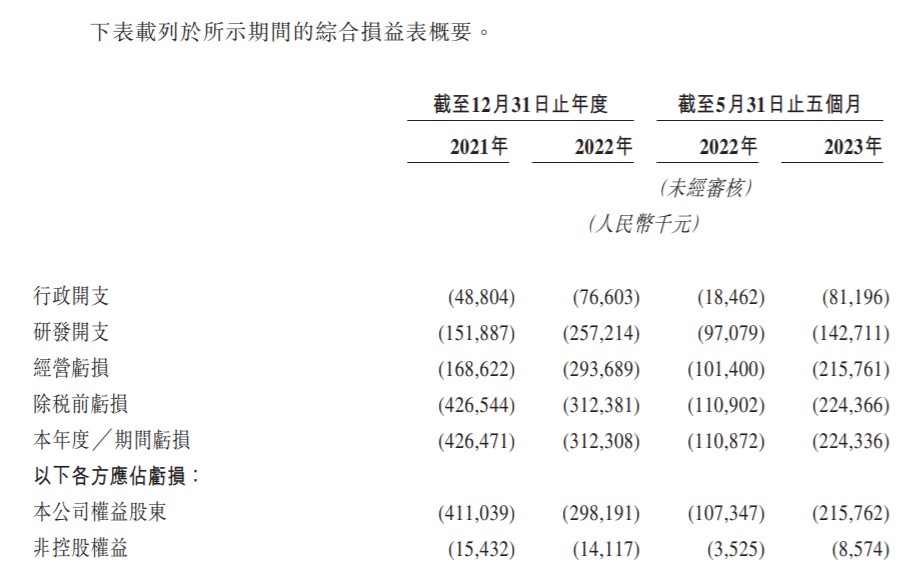
财务方面,公司于2021年、2022年未有营业收入,相应的研发开支分别为1.52亿、2.57亿元人民币,相应的净亏损分别为4.26亿、3.12亿元人民币。
据荃信生物在招股书中所述,公司很大程度上依赖候选药物的成功(公司的所有候选药物均处于临床前或临床开发阶段)。倘公司无法成功完成临床开发候选药物,或上述事项遭遇重大推迟,该司的业务前景将严重受损。
本文作者可以追加内容哦 !

